围产期干细胞大揭秘,到底有啥不同
2020-03-16
如今,每一位准爸准妈都可能会接触到一个词:干细胞。干细胞在人的一生中发挥着重要作用,是过去几十年里科学研究的热点之一。而伴随着宝宝的出生,还给我们带来了一种全新的资源:新生儿干细胞。
1988年,世界上第一例脐带血移植手术在法国巴黎的完成,这一事件催生了全球的新生儿干细胞库。
1992年,世界上第一个脐血库在纽约成立;2008年,台湾生宝生物第一个推出了脐带储存服务;2011年,LifebankUSA成了第一个提供胎盘储存的干细胞库。
面对不同来源的干细胞时,很多准爸准妈一头雾水,不知道它们有什么区别和关联。今天,我们就来盘点一下新生儿干细胞的宝库。
概要:
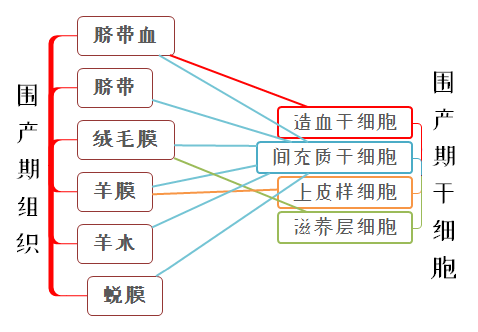
围产期脐带血、脐带和胎盘中的干细胞资源先后被发现、研究及应用。
围产期脐带、胎盘来源的间充质干细胞是干细胞应用的优质种子细胞,获取细胞数量较多,可多次使用,应用前景广阔。两者的差异主要在旁分泌功能,潜在应用领域可能存在差异。
由于造血干细胞研究成熟,脐带血长期以来被用于血液疾病、免疫疾病的治疗。而随着再生医学、免疫治疗技术的发展,脐带血中的其他干细胞和免疫细胞也倍受关注。
脐 带
1968年,德国科学家Friedenstein发现了间充质干细胞(MSCs);1991年,北爱尔兰科学家从脐带中培养出MSCs。
由于取材方便、无道德伦理争议、增殖能力强、免疫调节作用大、分泌生长因子总量高、便于扩增和传代等优势,脐带MSCs成了临床研究和应用的理想干细胞来源。
截止2019-3-19,ClinicalTrials.gov数据库中有175项脐带MSCs相关临床研究。
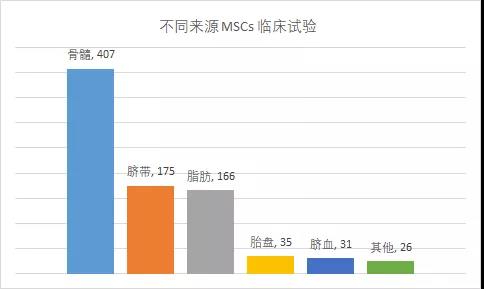
此前一篇文献,MSCs临床试验分来源显示(脐血从原脐带数据中分离)
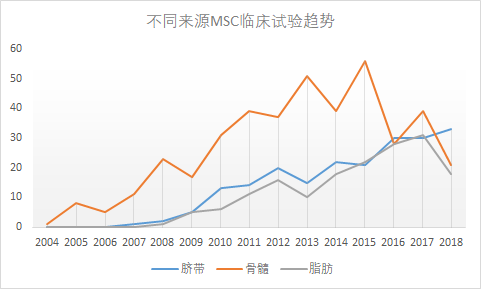
不同来源MSCs临床试验趋势(脐带含脐血数据)
据统计,2004 - 2018年间,脐带MSCs相关研究数量少于骨髓来源,多于脂肪、脐血、胎盘及其他来源。
从趋势来看,骨髓和脂肪相关研究在2016-2018出现下降,而脐带相关研究持续增长。
从国家来看,中国无疑是研究脐带MSCs最多的国家,在ClinicalTrials.gov上有124项临床试验,远远超过第二名韩国的24项,第三名美国的15项。
截止目前,在中国临床试验中心注册的干细胞临床试验共计378项,其中脐带MSCs临床试验62项,适应症包括糖尿病、膝关节炎、肝硬化、系统性红斑狼疮、卵巢功能障碍、子宫内膜修复、脑瘫、脊髓损伤、帕金森病、多发性硬化等。
脐带MSCs的新药研发同样方兴未艾,目前国家药品监督管理局药品审评中心受理的脐带间充质干细胞新药申请已有11项。
胎 盘
胎盘是胎儿与母体之间物质交换的重要器官,构造上可分为两部分,胎儿部分包括羊膜、绒毛板及绒毛组织,母体部分为蜕膜。
研究发现,胎儿和母体来源的MSCs具有相似的表型和多谱系分化潜能,但分离效率差异明显,每克组织中可分离提取的MSCs:脐带>羊膜>绒毛膜>蜕膜;细胞生长速率也有差异,从快到慢是:脐带>羊膜>绒毛膜>蜕膜。
似乎是位置越接近新生儿的组织,其MSCs含量及增殖能力越高。此外,不同来源MSCs在旁分泌因子表达上有很大差异,提示可能存在适应症的不同。
截止2020-1-14,有35项胎盘干细胞临床试验在ClinicalTrials.gov上登记。
从细胞来源来看,66%(23项)为间充质干细胞;20%(7项)为蜕膜基质细胞;11%(4项)登记为胎盘来源干细胞,其中2项是联合脐带血造血干细胞应用。
羊膜是胎盘干细胞研究的主力,但明确为羊膜来源的临床试验数量只有1例,77%(27项)临床试验未指明干细胞具体来源。
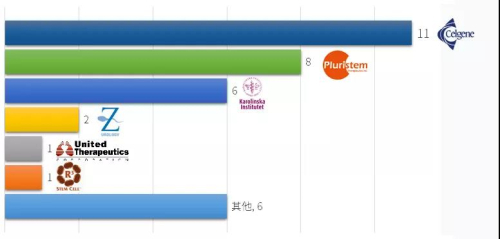
已完成的13项临床试验中,两家公司贡献了其中8项。
Pluristem公司的PLX-PAD完成了周围动脉疾病的2项1期临床试验和1项2期临床试验,1项全髋关节置换术的1/2期临床试验。Celularity公司的PDA001和PDA002,分别完成了克罗恩病和糖尿病并发症的1期和2期临床试验。从适应症上看,血管疾病、糖尿病及并发症、炎症和移植物抗宿主病(GvHD)相关临床试验开展较多。
除此之外,科学家还开展了大量临床前研究,已证实胎盘干细胞在组织纤维化、神经系统病变、自身免疫性疾病、消化系统疾病、心血管系统疾病等领域有广阔的应用前景。
脐 带 血
截止目前,脐带血仍是世界上应用最广泛的新生儿干细胞,已用于80多种疾病的治疗,全球应用超过50,000份。脐带血在ClinicalTrials.gov注册的相关临床试验约350项。
尽管总有核细胞数比骨髓少10-100单位,但脐带血具有高增殖潜能的造血干细胞概率大约是骨髓的8倍。相比其他来源的造血干细胞,脐带血具备以下优势:
▪ 复发率低
▪ GvHD严重程度轻
▪ HLA匹配要求可下调1-2个位点
▪ 巨细胞病毒和EB病毒传播风险较低
▪ 低温贮藏时单位时间温度下降可以更快
同时,脐带血移植也被广泛用于良性疾病:约37%的原发性免疫缺陷、血红蛋白病、骨髓衰竭综合征、组织细胞疾病或先天性代谢缺陷的患者采用脐血移植方案。
除了造血干细胞,脐带血中还含有其他具有多向分化能力的干细胞。
在ClinicalTrials.gov数据库中,有31项脐带血间充质干细胞相关临床研究,适应症包括GvHD、骨关节炎、支气管肺发育不良、阿尔茨海默病、自闭症、脑瘫等。例如,已完成的脑瘫或自闭症研究目前看来安全可行,在接受足够剂量细胞的患者身上得到的初步结果令人鼓舞。
此外,约1/3的脐带血CD34+细胞缺乏造血性CD45抗原,在特定的培养条件下,能够产生具有内皮特征和血管生成特性的克隆祖细胞,即内皮细胞集落形成细胞(ECFCs)。相对成体细胞,脐带血来源的ECFCs繁殖潜能更高,可作为细胞治疗产品用于血管再生,目前已在进行临床前研究。
值得注意的是,有报道称脐带血中存在一种原始干细胞群——极小胚胎样干细胞(VSELs)。这些细胞具有从HSCs到心肌细胞的多种细胞特性,是未来脐血在再生医学中进一步应用的生物学基础。
联 用
脐带和胎盘来源的MSCs与脐带血联合应用的好处主要来自以下三个方面:
1、脐带血扩增
将脐带血细胞与MSCs共培养是一种很有前景的方案,可以模拟造血龛内的生理微环境。因此,脐带和胎盘来源的干细胞可用于支持脐带血造血干细胞的体外扩增。
2、免疫调节
GvHD是导致移植病人死亡的主要原因之一。MSCs由于具备免疫调节特性,已被广泛用于治疗严重GvHD的研究,结果显示良好。
同样地,储存在干细胞库里的胎盘或脐带MSCs也可加速淋巴细胞的恢复,防止单倍体相合或HLA不匹配的供者在造血干细胞移植手术中失败。
3、再生医学
当脐血ECFCs与MSCs联合移植时,ECFCs和MSC之间表现出紧密的相互作用,ECFCs通过旁分泌生长因子和血小板衍生生长因子信号,传导调节MSC的凋亡和干细胞相关特性。
同样,体外共培养ECFCs和MSCs,通过NOTCH信号通路调节ECFCs的自我更新潜能和血管生成能力,从而增加ECFCs在体内的移植和血管生成潜能。这两种不同类型细胞之间的相互协同作用可以被最大限度地用于再生医学。
小 结
综上,脐带血和胎盘、脐带来源的干细胞各有优势,并且存在互补。胎盘、脐带来源的MSCs是干细胞治疗的优质种子细胞,开展的研究领域广泛,应用前景广阔。
由于提取技术的不同,获取的MSCs细胞数量较多,可多次使用。而MSCs之间的差异,主要是旁分泌功能的不同,导致潜在应用领域的不同。脐带血所含的细胞种类丰富,MSCs、ECFCs和VSELs等干细胞是其用于再生医学的基础;NK细胞、调节性T细胞等免疫细胞,是其未来在免疫治疗领域大显身手的基础;而造血干细胞是其能重建造血及免疫功能的基础。
总的来说,由于造血干细胞的存在,具备现实的治疗价值以及在再生医学及免疫治疗中的应用前景,脐带血仍是当前最具存储价值的新生儿干细胞。而脐带、胎盘来源MSCs和脐带血干细胞在作用上的互补关系、联合应用的前景,使同时保存多种新生儿干细胞成为一个选项。